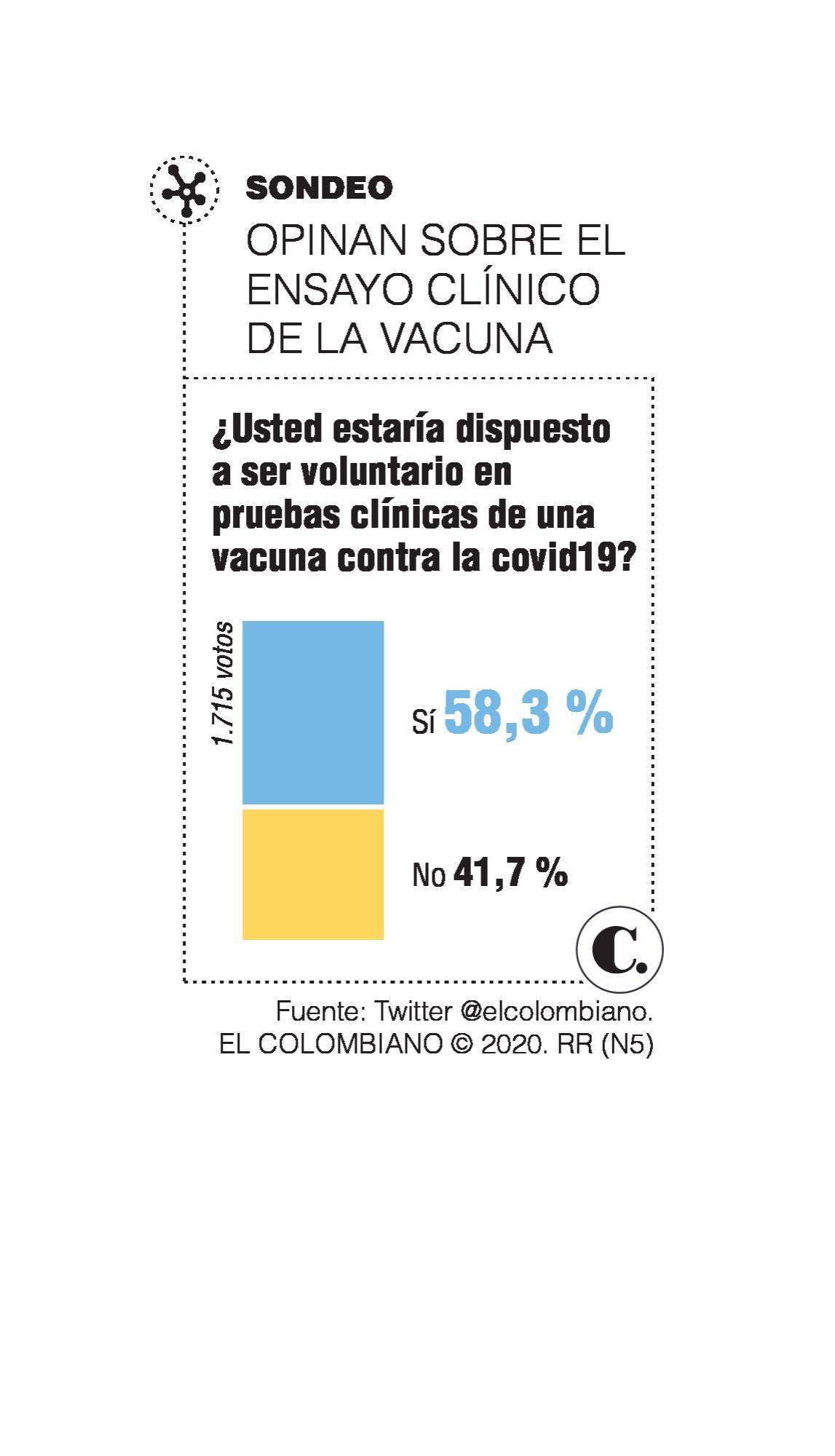
El anuncio de que Colombia participará, con al menos 3.600 ciudadanos, de los ensayos clínicos de la fase III de la vacuna contra el coronavirus que adelanta Janssen, laboratorio propiedad de Johnson & Johnson, se percibe como una noticia positiva, pero los analistas recomiendan que este anuncio se tome con calma.
En total, este ensayo clínico se aplicará en alrededor de 60.000 voluntarios, que estarán ubicados en Estados Unidos, Chile, Colombia, México, Perú y Sudáfrica.
El ensayo se daría hacia la segunda semana de septiembre y anoche el Invima confirmó la aprobación del ensayo clínico que será realizado en 15 centros de investigación, ubicados en Bucaramanga, Barranquilla, Bogotá, Medellín, Floridablanca y Cali.
En la fase III, la más avanzada, los ensayos se realizan en grandes grupos poblacionales para conocer el comportamiento del medicamento o vacuna que se está probando.
“Las conversaciones se venían adelantando de manera discreta. Asimismo, se han adelantado otras conversaciones con diferentes farmacéuticas”, dijo el ministro de Salud, Fernando Ruiz Gómez, el pasado lunes durante el programa Prevención y Acción.
Johnattan García Ruiz, magíster en salud pública de Harvard, señala que es un avance que muestra que el Gobierno Nacional se está moviendo en aras de negociar con el laboratorio que logre la vacuna que dé frutos. “La opinión pública debe tener los pies en la tierra, porque esto es un ensayo clínico y ya veremos qué nos dicen los resultados”.
Se espera que los resultados de este ensayo se conozcan en enero para que se pueda producir y aplicar en 2021, en caso de resultar exitosos.
¿Confidencial?
Carolina Gómez, exdirectora de Medicamentos del Ministerio de Salud y miembro del Centro de pensamiento de medicamentos de la U. Nacional, plantea que el hecho de que sea un acuerdo con la especificidad de la “confidencialidad” genera suspicacias.
“Es extraño porque el proceso de ensayos clínicos está regulado”, aseguró Gómez, quien planteó lo que pasa en este caso: “Es como si uno dijera que quiere importar televisores y va al Ministerio de Comercio a decirle qué opina”.
Esta duda también la planteó García Ruiz, quien señaló que la poca información que se tiene no permite saber cuáles son las condiciones, si Colombia será prioridad ni cuáles serán los precios. “Esto pone a los países en una situación de vulnerabilidad, porque no saben si los negocios que se están haciendo son abusivos o no”, agregó.
EL COLOMBIANO les preguntó al Minsalud y a Janssen las razones para que se tenga un acuerdo de confidencialidad en este caso.
El Minsalud señaló que las farmacéuticas lo solicitan porque están compartiendo información técnica y científica de productos que aún no cuentan con la suficiente protección de sus derechos de propiedad industrial o intelectual. “Para los gobiernos también tiene algún sentido porque están revelando su estrategia de acceso a las vacunas, cuyo presupuesto no está plenamente definido”.
Entretanto, Carlos Alvarado, director de Asuntos Médicos para Janssen en Latino América, le dijo a este diario que “nos encontramos en una etapa donde el protocolo aún requiere aprobaciones regulatorias”, agregó Alvarado.
¿Cómo son los ensayos?
Alvarado explicó que el procedimiento será explicado a los voluntarios que decidan participar en los estudios clínicos. “Serán seleccionados después de realizar una visita al centro de investigación y una valoración inicial. Posteriormente, se les administrará una dosis de la vacuna o de placebo”, dijo el vocero, quien destaco que se harán exámenes periódicos para probar la respuesta inmunológica, lo que “permite conocer qué tanta actividad de las defensas se genera”.
Andrés Fernández ya se contactó con el centro de investigación que realizará la prueba en Medellín. Aseguró que lo hace bajo el principio de cooperación, entendiendo que es un aporte que puede dar en aras de encontrar una cura contra el coronavirus.
“Llené un formulario con datos básicos, me preguntaron si tenía enfermedades y que cuándo me había aplicado la última vacuna”, señaló Fernández, al destacar que apenas empezó el proceso. “Esta decisión ha sido voluntaria y estoy esperando el momento para cooperar con la ciencia”.
La exdirectora de Medicamentos del Minsalud destacó que el Invima es la autoridad encargada de autorizar los protocolos del laboratorio para el ensayo. Además, recordó que quien quiera hacer parte del ensayo debe dar un consentimiento informado ante los posibles efectos adversos de, en este caso, la vacuna. “Este protocolo debe ser aprobado por un comité de ética”.
Sobre esos comités, Stella Navarro, médica de la Universidad CES con máster en bioética de la Universidad El Bosque, agregó que se encargan de avalar las investigaciones, pero cada institución revisa los protocolos presentados.
“Se analiza cómo se evalúa la relación riesgo-beneficio del ensayo, que es lo más importante. Además, que se tenga claro que la población no se expone de manera injustificada a este o si las personas son vulnerables y no se están aprovechando de eso” para adelantar el ensayo, y agregó que estos comités están integrados por bioeticistas, abogados, expertos en investigación, epidemiólogos y representantes de la comunidad.